|
Etude des relations Structure-Fonction chez les Laccases. Personnes impliquées: T. Tron, C. Gaudin, G. Iacazio |
* Laccases
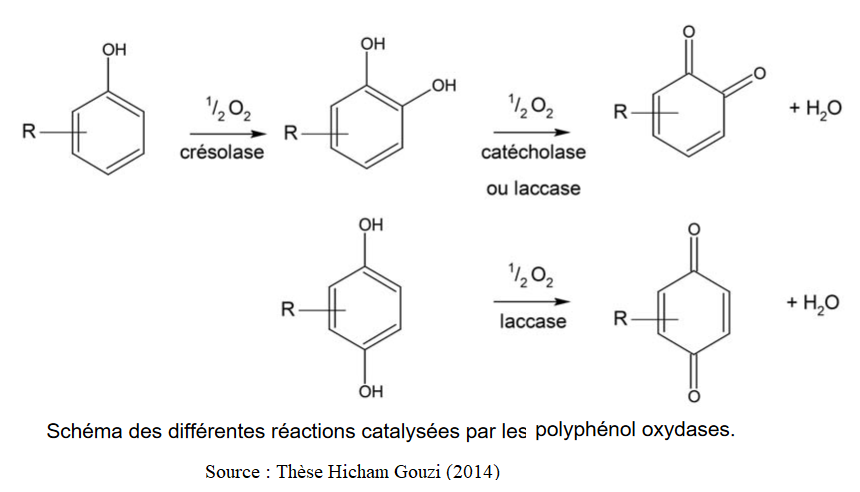
Les laccases sont des enzymes à cuivre qui oxydent les polyphénols en utilisant l'oxygène comme accepteur final d'electrons. Elles sont présentes dans les plantes, dans de très nombreux champignons (dégradation de la lignine) ainsi que dans quelques bactéries.
* Structures connues de Laccases:
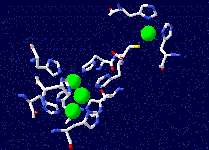
Leur site actif
est constitué de 4 atomes de cuivre,
un de type 1, isolé, responsable de l'oxydation des
phénols et un cluster de 3 atomes de cuivre (1 de type 2 et
2 de
type 3) responsable de l'activation du dioxygène.
* Mécanisme d'action:
Le mécanisme d'action des laccases et notamment le rôle du centre métallique, reste mal connu. Il est admis un mécanisme en deux temps :
- le cuivre T1 arrache un électron au substrat
-
l'électron est transféré au centre T2/T3 sur une distance d'environ 12,5 Å . Après complète réduction du centre trinucléaire, la réduction de l'oxygène moléculaire intervient.
* Etude moléculaire des laccases issues du basidiomycète C30:
La
littérature sur la dégradation biologique de
la lignine et sa biosynthèse met en évidence
l'intervention de laccases et de peroxydases dont les rôles
respectifs exacts dans l'oxydation des structures
moléculaires
de la lignine sont loin d'être complètement
éclaircis.
Notre travail porte
principalement sur la caractérisation des laccases du
basidiomycète C30.
Ce champignon a
été prélevé sur une
litière de
chênes verts dans le var et ses principales
caractéristiques métaboliques et
potentialités
enzymatiques ont été décrites (Tagger et
al,
1998, [1]).
La séparation et la
purification des laccases sécrétées
par la souche
C30 dans le milieu de culture (Dédeyan, 1996, [2]) ont
montré la présence d'au moins 3 enzymes. La
laccase 1
étant largement majoritaire bien que présentant
une
activité spécifique nettement plus faible que
celle des
deux autres laccases a été
caractérisée
plus en détails (pH optimum, pI,
séquençage de
l’extrémité N-terminale et composition
de la
fraction glycosylée). Les techniques spectroscopiques
(absorption atomique, RPE), ont montré que cette enzyme
possède 4 atomes de cuivre dont l’arrangement
correspond
aux enzymes classées dans la famille des oxydases bleues
à cuivre (Dédeyan et
al, 2000, [3]).
Plus
récemment, grâce à des modifications
des conditions de culture (influence de la teneur en cuivre, nature des
inducteurs), il a été observé une
complexité plus grande (5 ou 6 isoenzymes au lieu de 3)
relative
à la production de laccases par la souche C30 (Klonowska et
al, 2001 [4]). La
caractérisation des laccases se fait donc
au fur et à mesure de leur révélation,
le but
étant de déterminer les mécanismes de
régulation de leur synthèse,
d’établir une
liste de leurs substrats naturels et des inducteurs de cette
synthèse. Ainsi, une laccase 2 a été
caractérisée récemment et ses
propriétés comparées à
celles de la laccase
1 (Klonowska et al,
2002 [5]).
Une
récente
étude au niveau moléculaire des ADN ribosomaux de
ce
champignon, qui avait été au départ
improprement
considéré comme une souche de Marasmius
quercophilus,
a montré qu'il s'agissait en fait d'une souche de Trametes
(Klonowska et al,
2003 [6])
Si
l'intérêt des laccases n'est plus à
démontrer, une des limitations à leur utilisation
massive
est très probablement liée aux
difficultés de
manipulation des organismes qui les produisent. La sélection
des
champignons, leur culture et la production de
polyphénoloxydases
sont des étapes souvent longues et aléatoires.
Nous avons
donc envisagé:
- De cloner les gènes codant pour les laccases issues de Trametes C30 et de les exprimer dans un hôte hétérologue.
- D'utiliser ce système pour produire et étudier des enzymes modifiées afin de mettre au point des outils plus performants dans le domaine d'action des laccases.
Un premier résultat dans cette voie a été l'obtention et la caractérisation d'un nouvel enzyme, par expression dans Saccharomyces cerevisiae, la laccase 3, qui n'était pas présent (ou indécelable) dans le milieu de culture du champignon (Klonowska et al, 2005 [8]).
Références:
[1] S. Tagger, C. Perissol, G. Gil, G. Vogt, J. Le Petit, 1998. Phenoloxidases of the white-rot fungus Marasmius quercophilus isolated from an evergreen oak litter (Quercus ilex L.) Enzyme Microbiol. Technol. 23, 372-379.
[2] B. Dédeyan, 1996. Purification et caractérisation des laccases de Marasmius quercophilus. Thèse de l'Université d'Aix-Marseille III.
[3] B. Dédeyan, A. Klonowska, S. Tagger, T. Tron, G. Iacazio, G. Gil, J. Le Petit, 2000. Biochemical and molecular characterization of a laccase from Marasmius quercophilus. Appl. Environ. Microbiol., 66, 925-929.
[4] A. Klonowska, J. Le Petit, T. Tron, 2001. Enhancement of minor laccases production in the basidiomycete Marasmius quercophilus C30. FEMS Microbiol Lett. 200, 25-30.
[5] A. Klonowska, C. Gaudin, A. Fournel, M. Asso, J. Le Petit, M. Giorgi, T. Tron, 2002. Characterization of low redox potential laccase from Basidiomycete C30. European Journal of Biochemistry. 269, 6119-6125.
[6] A. Klonowska, C. Gaudin, M. Ruzzi, M. C. Colao, T. Tron, 2003. Ribosomal DNA sequences analysis show that the basidiomycete C30 belongs to the genus Trametes. Research in Microbiology. 154, 25-28.
[7] A. Klonowska, 2000. Expression hétérologue de laccases du champignon Marasmius quercophilus chez la levure Saccharomyces cerevisiae. Thèse de l'Université d'Aix-Marseille III.
[8] A.
Klonowska, C. Gaudin, M. Asso, A. Fournel, M. Reglier,
T. Tron, 2005. Lac3, a new low redox potential laccase from Trametes
C30 obtained as a recombinant protein in yeast. Enzyme and Microbial
Technology. 36,
24-41
* Projets:
Une
étude de l'influence de mutations au niveau de
l'environnement du site actif est programmée pour identifier
les
résidus responsables des variations observées
d'activités spécifiques, d'affinités
et de
potentiels redox chez les differentes laccases
étudiées.
Publications
Activité du groupe aujourd'hui
Retour